Curso-taller
InForMed. 8 de Abril de 2008. Palma de Mallorca
Posicionamiento de los
medicamentos en guías terapéuticas y
protocolos clínicos
DOCUMENTO BASE. Versión 1.0 (03-04-2008) De apoyo al curso día 8 de Abril 2008
Documento completo, información adicional, presentaciones
PPT y próximas versiones en: http://www.elcomprimido.com/FARHSD/DocenPortalCursoPosicTerapeuticoAbril2008.htm
2. POSICIONAMIENTO TERAPÉUTICO: PROCEDIMIENTOS
Esta parte del
documento se ha estructurado con el objeto de facilitar el posicionamiento
terapéutico de los medicamentos en la práctica.
Teniendo siempre como
referencia los cuatro criterios o pilares de
la selección de medicamentos, efectividad, seguridad, conveniencia y
coste, el procedimiento de posicionar los fármacos dentro de un esquema
terapéutico incluye tres pasos que se resumen a continuación.
|
Paso 1. Identificar las fuentes de información base
para elaborar el esquema terapéutico inicial. |
|
Paso
2. Comprobar
la consistencia de las propuestas terapéuticas de las publicaciones
anteriores. |
|
Paso 3.
Adoptar un esquema terapéutico. Para
ello se aplicarán los criterios primarios y secundarios, que hemos comentado
previamente: eficacia, seguridad, conveniencia y coste |
|
Paso 1. Identificar las
fuentes de información base para elaborar el esquema terapéutico inicial. |
|
Según el esquema explicado en
la introducción, se localizarán y revisarán:
1- “SINOPSIS PROPIAS”: Guías y
Protocolos terapéuticos redactados por facultativos pertenecientes al Servei de
Salut de les Illes Balears, tanto del nivel asistencial de especializada como
de primaria. 2- “SINOPSIS DE REFERENCIA”:
-Guías de Práctica Clínica basadas en la evidencia.
-Guías Terapéuticas y Guías clínicas.
-Fuentes secundarias
elaboradas por expertos.
3-REVISIONES SISTEMATICAS. Incluyendo metanálisis
(Ej: Cochrane, ...). |
Ver anexo 1 (pág
32): Información ampliada sobre
el paso 1.
|
Paso
2. Comprobar
la consistencia de las propuestas terapéuticas de las publicaciones
anteriores. |
|
Se revisará la siguiente
información, 1- Fuentes secundarias de tipo
independiente a-Boletines
publicados por centros de documentación de comunidades autónomas y revisiones
de referencia internacional b-Informes
y evaluaciones de centros de documentación independiente c-Informes
de otros centros de referencia internacional
d-
Editoriales de revistas e-Opiniones
de expertos, cartas al editor Si hay divergencias substanciales en las
publicaciones anteriores y con
respecto a las Sinopsis del paso 1, o bien si las propuestas de las fuentes anteriores
solo llegan a nivel de grupo terapéutico y no especifican un principio
activo, se revisarán: 2- Ensayos clínicos originales
de referencia publicados (ó metanálisis) |
Ver anexo 2
(pág 35) información ampliada del paso
2.
|
Paso 3.
Adoptar un esquema
terapéutico, definiendo el lugar en el mismo del fármaco estudiado. Para
ello se aplicarán los criterios primarios y secundarios, que hemos comentado
previamente: eficacia, seguridad, adecuación y coste |
|
Paso
3.1: Evaluar eficacia Partiendo del/los ensayo/s
clínico/s (o metanálisis) Para cada fármaco que comparamos evaluar: Evidencias de mayor eficacia:
-Magnitud
del resultado de eficacia y relevancia -Aplicabilidad
a nuestros pacientes -Nivel
de evidencia SORT En anexo 3.1.a: Información ampliada pág 38 Evidencias
de equivalencia de eficacia:
-Aplicar niveles y grados de evidencia de equivalencia terapéutica En anexo 3.1.b: Información ampliada pág 42 Paso
3.2: Evaluar Seguridad. Evaluar Beneficio riesgo comparado En anexo 3.2:
Información ampliada pág 44
Paso 3.3 Conveniencia
En anexo 3.3:
Información ampliada pág 46
Paso 3.4 Coste
Medicamentos Equivalentes de eficacia y seguridad. Hacer estudio de minimización. Medir
impacto económico Medicamentos con diferencias pequeñas de
eficacia y grandes de coste de adquisición
CEI publicados y CEI datos propios. Medir impacto económico En anexo 3.4: Información ampliada pág 47 |
|
Paso
3.5 Posicionamiento en 1ª linea y alternativas. Aplicar los
algoritmos y criterios presentados anteriormente: a-Si uno de los
fármacos presenta diferencias contrastadas de su relación beneficio riesgo
sobre los demás. -Si
las diferencias son sustanciales: Adoptar dicho fármaco como de elección. -En
caso de que la diferencia de coste sea muy elevada, valorar bien la relevancia clínica de la diferencia del
beneficio riesgo entre los fármacos para la misma indicación y calcular el
CEI. En base a relevancia de resultados y CEI, ajustar indicaciones al subgrupo de pacientes que más pueden
beneficiarse. Aplicar algoritmo 1 del capítulo anterior. -Si las diferencias son modestas.
Adoptar dicho fármaco como de elección
siempre y cuando la seguridad y
los criterios secundarios sean favorables. Aplicar algoritmo 3 del capítulo
anterior b-Si hay más de un
fármaco con una relación beneficio riesgo similar, ver en segundo nivel
conveniencia y coste para elegir Si
los fármacos presentan relaciones similares de beneficio riesgo y uno de ellos presenta ventajas sustanciales
de conveniencia con impacto en la efectividad, adoptar dicho fármaco como de
elección. En
caso de coste comparado muy elevado valorar bien la relevancia clínica de la
diferencia del nivel de conveniencia entre los fármacos para la misma
indicación y calcular el CEI. En base a relevancia de la conveniencia y
CEI, ajustar indicaciones al subgrupo
de pacientes que más pueden beneficiarse Aplicar
algoritmo 2 del capítulo anterior. c-Definir el fármaco
de segunda línea, en casos específicos en que no esta indicado el de
primera línea: -a) en base a
contraindicaciones, interacciones, alergias -b) en base a falta de respuesta al fármaco de primera elección. -c)
pacientes con características especiales que modifican
el metabolismo -d)
en base a beneficio-riesgo por subgrupos. Aplicar el algoritmo 4 del
capítulo anterior Algoritmos y criterios para realizar el posicionamiento, ver
capítulo anterior (pág 9) |
ANEXOS
del Tema 3
Anexo 1:
Identificar
las fuentes de información base para elaborar el esquema terapéutico inicial.
En general toda la información
se basará preferentemente en las publicaciones de los últimos 5 años. Se localizarán
y revisarán:
1-Guías y Protocolos terapéuticos redactados por facultativos
pertenecientes al Servei Balear de la Salut. En función del ámbito sobre el que
se esté trabajando:
-Consultar publicaciones de
Atención Primaria
GAP Mallorca,
Ibiza-Formentera, Menorca
-Consultar protocolos y Guías Hospitales, especialmente las
vigentes en el centro donde se redacta el documento
Web HUSD http://www.elcomprimido.com/FARHSD/PORTAL.htm
Web HSLL http://www.hsll.es
Web el comprimido: http://www.elcomprimido.com/
preguntar otros centros
-Consultar Guía
Farmacoterapéutica interniveles de IB (GFIB)
Web: http://www.elcomprimido.com/informed07/portal_informed_07_cast.htm
Web: http://www.elcomprimido.com/GFIB/guia_portada.htm
Web:http://www.elcomprimido.com/INFORMED/PDC2.htm
2-Guías
de Práctica Clínica basadas en la evidencia
-De referencia a nivel internacional, redactadas por
las sociedades científicas o por organismos independientes y de
referencia para el tema estudiado.
Se priorizarán las GPC que
tengan en cuenta no sólo los aspectos de medicina basada en la evidencia, con
grados de recomendación derivados de la calidad de la evidencia científica
aportada por los estudios, sino también las GPC que tengan en cuenta los aspectos de eficiencia, como estudios
farmacoeconómicos de coste utilidad o de coste efectividad incremental.
En
este sentido pueden ser de interés las GPC elaborados o compiladas por
► NICE. National Institute
for Clinical Excellence http://www.nice.org.uk/
► SIGN The Scottish Intercollegiate Guidelines Network http://www.sign.ac.uk
► PRODIGY. NHS. http://www.cks.library.nhs.uk/clinical_knowledge/clinical_topics
► CANADA. CMA http://mdm.ca/cpgsnew/cpgs/index.asp
► NUEVA ZELANDA http://www.nzgg.org.nz/
-Producidas
por sociedades científicas y agencias de evaluación de tecnologías sanitarias
del estado español:
►
GUIA SALUD.
GPC del sistema nacional de salud http://www.guiasalud.es/newCatalogo.asp
-Producidas por sociedades científicas del nuestro país,
consultando las publicaciones de las mismas en la página web de la sociedad
científica o en otras fuentes Algunos ejemplos:
Fisterra-e, Sociedad Española de Cardiología,
SEIM, etc .Ver tema 4 pág 55 para información completa y estrategias de búsqueda.
-Considerar otras fuentes de búsqueda de GPC de referencia internacional basadas en la
MBE
COMPILADORES O BUSCADORES de GPC
► NGC (National Guideline Clearinghouse) http://www.guidelines.gov
► GUIDELINES INTERNATIONAL
NETWORK http://www.g-i-n.net/
► GPC Rafa Bravo
http://infodoctor.org/rafabravo/guidelines.htm
METABUSCADORES
Y BUSCADORES:
-TRIP database http://www.tripdatabase.com/index.html
-Scholar google. http://www.scholar.google.com/
-Pubgle
http://www.pubgle.com/quees.htm
-Sum
Search http://sumsearch.uthscsa.edu/espanol.htm
-Drug information portal NLM USA http://druginfo.nlm.nih.gov/drugportal/drugportal.jsp
-BASES DE DATOS
-Medline (ver en
anexo x estrategia de búsqueda GPC)
-Embase.com (ver en anexo x estrategia de busqueda PC)
Ver tema 4
para información completa y
estrategias de búsqueda
-PLATAFORMAS:
-Las disponibles en la Biblioteca virtual de IB.
Web
HUSD http://www.elcomprimido.com/FARHSD/ENLACESBASESDATOS.htm
Web Biblio Virtual IB: http://www.bibliosalut.com
3-Fuentes secundarias elaboradas por expertos: Recursos basados en MBE,
compendios y sinopsis basados en revisiones realizadas de forma sistemática.
Libros, manuales, Guías terapéutica
y bases de información biomédica actualizados y de referencia
-Up
to date. Teniendo en cuenta que es una fuente de consulta frecuente y de
referencia para muchos profesionales, y que está incorporada a la biblioteca
virtual de les Illes Balears de acceso corporativo.
-Guía Terapéutica en Atención Primaria.
Basada en la Evidencia. 3 ª ed. Sociedad Española de Medicina de Familia y
Comunitaria. SemFYC. Barcelona
2007
http://www.guiaterapeutica.net/3edicion+/
-Medimecum,
Para aspectos específicos, se considera una fuente de información cuyos
contenidos son redactados con independencia y criterio
http://www.medimecum.com/login.aspx?ReturnUrl=%2fDefault.aspx
-BNF. Y su versión en español disponible en
la página de la AGEMED como “Guía de Prescripción Terapéutica
http://www.agemed.es/profHumana/gpt/home.htm
Los libros o manuales de referencia para cada tema
de terapéutica
4-Revisiones
sistemáticas y metanálisis (Cochrane, ...)
BIBLIOTECA
COCHRANE: versiones
A las diferentes bases de datos contenidas en la
biblioteca Cochrane, puede accederse desde diferentes plataformas desde la
Biblioteca Virtual de IB: http://www.bibliosalut.com
|
|
|
PubMed Plataforma |
http://dgaval.caib.es/biblioteca-virtual.htm
· Cochrane
“CDSR” (Sytematic Reviews)
|
|
OVID-SP Plataforma |
http://dgaval.caib.es/biblioteca-virtual.htm ·
Cochrane “Completo”: -CDSR
(Systematic Reviews) -DARE
(Database Abstracts Reviews Effectiveness) -CCRCT
(Central Register of Controlled
Trials) -CMR
(Metodology Register) -HTA (Health Technology Assessment) -NHS EED (Economic Evaluation Database) |
|
EMBASE.com |
http://dgaval.caib.es/biblioteca_virtual.htm
·
Cochrane “CDSR” |
|
EBSCO-HOST Plataforma |
http://dgaval.caib.es/biblioteca_virtual.htm
·
Cochrane “Básico” (CDSR + DARE + CCRCT) |
|
WOK (ISI WEB OF KNOWLEDGE)Plataforma |
|
|
COCHRANE-PLUS |
http://dgaval.caib.es/biblioteca-virtual.htm ·
Cochrane CDSR en español ·
CCRCT (Central Register of
Controlled Trials) -CMR
(Metodology Register) -HTA (Health Technology Assessment) -NHS
EED (Economic Evaluation Database) |
ESTRATEGIA
DE BUSQUEDA EN LAS PLATAFORMAS Y BASES
DE DASTOS ANTERIORES
Ver tema
4 para información completa y estrategias de búsqueda
Referencias de interés:
Carlos González
Guitián Recursos de información
útiles para la toma de decisiones. Guías Clínica 2008; 8 supi1: 1 ( 12-02-2008)
http://www.fisterra.com/mbe/mbe_temas/14/recursos_mbe.asp
Grupo MBE Galicia: ¿Cómo hacer unan revisión clínica con fuentes
MBE? (7-01-2005).
http://www.fisterra.com/mbe/mbe_temas/revClinica/revisionClinica.pdf
Se comprobará la consistencia de
las propuestas terapéuticas de las publicaciones anteriores, revisando:
Rigor, validez y fiabilidad de
las mismas.
Para ello se determinará el
grado de coincidencia en los temas sustanciales de posicionamiento
farmacoterapéutico entre las diferentes propuestas presentes en dichos
documentos y en caso necesario se contrastarán sus conclusiones con las
propuestas de posicionamiento terapéutico de las fuentes de tipo independiente
que se citan más adelante.
Si existe una coincidencia de
propuestas en cuanto a la selección del fármaco para la indicación estudiada,
se adoptará esa para su posicionamiento terapéutico en la Guía o Protocolo
Terapéutico que estamos elaborando.
-Si hay divergencias
sustanciales, o bien
-Si el fármaco que estamos
estudiando por su novedad no está todavía incorporada a dichas guías, o bien
-Si las propuestas de las
fuentes anteriores solo llegan a nivel de grupo terapéutico y no especifican un
principio activo,
Se revisará información adicional:
1-
Fuentes secundarias de tipo independiente
2-
Ensayos clínicos originales de referencia publicados (ó metanálisis)
1-Fuentes
secundarias de tipo independiente
a) Boletines publicados por
centros de documentación de comunidades autónomas y revisiones de referencia
internacional
-Boletines
de referencia publicados en España ver en:
Web elcomprimido.com: http://www.elcomprimido.com/elcomprimido_links.htm
Web Génesis: http://genesis.sefh.es/Enlaces/Boletines.htm
b)Informes y evaluaciones de
centros de documentación independiente
Centros de documentación de las
comunidades autónomas de nuestro país
-Informes
evaluación de centros de documentación de nuestro país (CADIME, CEVIME, CANM,
AEMPA, etc) enlace
http://genesis.sefh.es/Enlaces/InformesCentrosAuton.htm
-Informes
evaluación hospitales españoles GENESIS enlace:
http://genesis.sefh.es/Enlaces/InformesHospitales.htm
c)Informes de otros centros de referencia
internacional,...)
-Revisiones
y evaluaciones de medicamentos publicadas por expertos en evaluación como los
del NHS británico:
Ver en
http://www.nelm.nhs.uk
MTRAC (Midlands Therapeutics Review and
Advissory Committee)
http://www.keele.ac.uk/schools/pharm/MTRAC/ProductInfo/prdrecm.htm
UKMi,(UK Medicines Information Pharmacists
Group)
MeReC
http://www.npc.co.uk/merec_bulletins.htm#
Regional Drug & Therapeutic Centre
http://www.nyrdtc.nhs.uk/publications/Eval_rpts/eval_rpts.php
Crentre for Reviews and Dissemination:
http://www.york.ac.uk/inst/crd/
Scottish Medicine Consortium:
http://www.scottishmedicines.org/smc/CCC_FirstPage.jsp
SIGN
NICE
Canadá
http://www.cadth.ca/index.php/en/hta/reports-publications/search?&type=22
EuroScan:
http://www.euroscan.bham.ac.uk/index.htm
RADAR:
http://www.npsradar.org.au/site.php?page=1&content=/npsradar/content/index.html
Drug Dex Micromedex
http://www.thomsonhc.com/home/dispatch
Revista Prescrire.
d)Editoriales
de revistas
e)Opiniones
de expertos, cartas al editor, ...
Metabuscadores
personales
Para localizar los documentos
las fuentes secundarias de tipo independiente, pueden ser de utilidad los
Metabuscadores. Entre los metabuscadores personales específicos de fuentes
independientes:
►Ernesto
Barrera http://www.google.com/coop/cse?cx=017503224239761697087%3Akl-ly1ji8_a
►Andrew Both http://www.google.com/coop/cse?cx=004326897958477606950:djcbsrxkatm
►Marcus
Tolentino http://www.google.com/coop/cse?cx=015151609256227371949:odk1sr9rtis
►Fernando
do Pazo http://www.google.com/coop/cse?cx=004681290781776855341%3A1tprgcbskcu&hl=es
2-
Ensayos clínicos originales de referencia publicados (ó metanálisis)
En caso de duda después de revisar la documentación
anterior, podemos acceder al ensayo clínico (o a los metanálisis) originales.
En primer lugar y en las fuentes
anteriores, identificar los ensayos clínicos relevantes de las opciones
estudiadas.
Mediante su lectura crítica
tratar de posicionar el fármaco idóneo
entre los estudiados. Valorar para la aplicación de los criterios de elección
del principio activo con los definidos como idóneos en los algoritmos.
En general con toda la
información anterior podemos centrar la comparación en unos pocos fármacos,
muchas veces sólo en dos.
|
Posicionamiento
terapéutico: Resumen pasos 1 y 2 |
|
|
Ver tema 4 para información completa y
estrategias de búsqueda
|
Paso 3. Adoptar un esquema terapéutico,
definiendo el lugar en el mismo del fármaco estudiado. Para ello se aplicarán
los criterios primarios y secundarios, que hemos comentado previamente:
eficacia, seguridad, conveniencia y coste |
Anexo 3.1.a
a)Evaluar eficacia.
|
|
Ver si hay ensayos clínicos comparativos
directos entre los dos medicamentos que se quieren comparar.
Ver si hay ensayos indirectos de cada
medicamento con un tercer comparador común (ensayos o metanálisis) para
comparaciones indirectas.
A partir de ellos evaluar:
a) si hay
evidencias de mayor eficacia de alguno de los fármacos.
b) si hay
evidencias de equivalencia terapéutica entre ambos
a) Evidencias de mayor eficacia:
Partiendo del/los
ensayo/s clínico/s (o metanálisis) Para cada fármaco que comparamos evaluar:
-Magnitud
del resultado de eficacia y relevancia
-Aplicabilidad
a nuestros pacientes
-Nivel
de evidencia SORT
|
|
-Para
valorar la magnitud y relevancia
clínica de los resultados de eficacia:
Puede ser útil, el extraer y expresar los resultados en forma de
RAR y NNT, según el esquema Génesis (http://genesis.sefh.es). En general el basarnos en la diferencia absoluta de riesgos (RAR) y el NNT facilita interpretar la relevancia
clínica de los resultados de eficacia. (tabla 1)
|
Tabla. 1 Forma de presentar los
resultados de un ensayo clínico. Resultados en variables binarias |
|||||
|
Variable evaluada en
el estudio |
Trat
estudiado N
(nº pac)** |
Trat
control N
(nº pac)** |
RAR
(IC 95%) * Diferencia Riesgo Absoluto * |
P |
NNT (IC 95%)* |
|
Resultado
principal -Breve descripción variable |
% |
% |
% ( IC95 : x% a x%) |
P |
X ( x a x) |
|
Para variables no binarias y para cálculo de IC95%, consultar
el programa Madre de Génesis http://genesis.sefh.es
) |
|||||
En caso de
falta de estudios directos, ver si se dispone de estudios con un tercer comparador
común. En este caso valorar el RAR, el RR, el NNT y sus IC95%. Tabular para facilitar la comparación,
comprobando previamente si son similares las características de los pacientes
en ambos estudios. Mediante la comparación
indirecta podemos estimar una aproximación a
la magnitud y relevancia clínica de la diferencia de eficacia entre los
medicamentos evaluados. Ver esquema de la tabla 2.
|
Tabla 2 Eficacia comparada entre los distintos fármacos.
Estudios independientes frente a un tercer comparador común |
|||||
|
|
Variable |
|
|
|
|
|
|
Resultado Fármaco |
Resultado Control |
RAR (IC 95%) |
NNT (IC 95%) |
RR (IC95%) |
|
Ensayo a |
A (IC 95%) |
B(IC95%) |
A-B (IC95%) |
X (IC 95%) |
X (IC 95%) |
|
Ensayo b |
A (IC 95%) |
B´(IC95%) |
A-B (IC95%) |
X
(IC 95%) |
X
(IC 95%) |
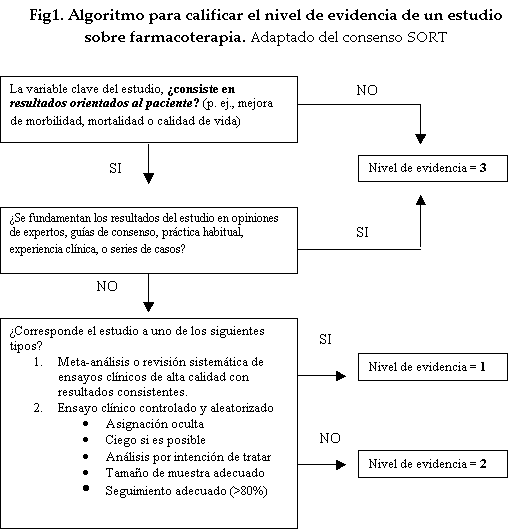
-Para valorar el nivel de evidencia
Tomar como
referencia el esquema del consenso SORT de 2004 (Ver figura 1) (Ebell MH Am Fam Physician 2004), que ha revisado la evaluación de los grados de
evidencia, otorgando una calificación de 1 ó 2 exclusivamente a estudios que se
centren en variables clínicas finales, u “orientadas al paciente”, p. ej.,
morbilidad o mortalidad.
Si, por el
contrario, el estudio se centra exclusivamente en variables intermedias,
subrogadas u “orientadas a la enfermedad”, no se le otorga una calificación
superior a 3, aunque sea un gran ensayo
clínico o un meta-análisis.
Se considera
que los ensayos deben aportar un nivel de evidencia de tipo 1. Soló si no hay
estudios de dicho nivel se podrán considerar también los de nivel 2 del esquema de SORT.
|
|
Ref: Ebell MH et al Strength of
Recommendation Taxonomy (SORT): A patient-centered approach to grading
evidencie in the medical literature. Am Fam Physician 2004, 69: 548-56
-Para valorar la aplicabilidad repasar las siguientes preguntas
(tabla 3):
|
Tabla 3 CUESTIONARIO SOBRE LA APLICABILIDAD DE UN
ENSAYO CLÍNICO |
||
|
|
SI /NO |
JUSTIFICAR |
|
¿Considera adecuado el comparador? ¿Es el tratamiento control adecuado en nuestro medio? |
|
Comparador, pauta, dosis, ¿es el tiempo de tratamiento el adecuado? |
|
¿Son importantes clínicamente los
resultados? |
|
¿se podría considerar la diferencia obtenida como
mejora clínica relevante? |
|
¿Considera adecuada la variable de medida utilizada? |
|
¿es la variable evaluada un resultado medido
habitualmente en la clínica? |
|
¿Considera adecuados los criterios de inclusión y/o exclusión
de los pacientes? |
|
¿Nuestros pacientes son como los de la
población estudiada? |
|
¿Cree que los resultados pueden ser aplicados directamente a
la práctica clínica? |
|
¿La práctica asistencial ensayada es
factible? |
|
Otros sesgos o limitaciones encontradas en el estudio |
|
Comentarios |
Los resultados de
este cuestionario nos ayudan a determinar la validez externa y aplicabilidad de
los resultados del ensayo.
-Con los tres criterios anteriores (Magnitud, Nivel de evidencia
y Aplicabilidad):
Definir si los
dos o más fármacos que comparamos presentan una diferencia que puede considerar
como:
-
mejora importante de eficacia
-
mejora modesta de eficacia
con su
valoración de aplicabilidad y nivel de evidencia SORT.
Si no queda
claramente definido uno de los fármacos evaluados como más eficaz o superior, pasar
a determinar si entre ambos fármacos hay Evidencias de equivalencia de
eficacia
b) Evidencias de equivalencia de eficacia:
Son varios los tipos
de estudios que nos permiten definir dos fármacos como equivalentes
terapéuticos.
En primer lugar es
importante determinar si hay ensayos clínicos comparativos directos entre las
dos opciones comparadas. En dicho caso los estudios pueden plantearse para
determinar si una de las opciones es superior a la otra (estudios de
superioridad) , o bien puede tratarse de estudios de equivalencia o
de estudios de no inferioridad. En los últimos años este último tipo de
estudios es cada vez más frecuente.
Los estudios
comparativos directos de equivalencia o de no inferioridad permiten evidenciar
la equivalencia terapéutica.
Existen otros tipos
de ensayos en los que no se puede evidenciar la equivalencia pero si estimar. Se trata por ejemplo de
los ensayos comparativos directos de superioridad con resultados negativos
(sean o no significativos) y los ensayos independientes de los fármacos
estudiados que los comparan con un tercer comparador común..
Para la
interpretación de los ensayos directos de superioridad debe tenerse en cuenta
que se considera relevante y los IC 95%.
Consultar las
referencias:
-Pinteño
M, Martínez-López I, Delgado O. Equivalentes terapéuticos: Concepto y niveles
de evidencia. El Comprimido.com 2006; nº 6: 14-18. http://www.elcomprimido.com/articulos%20PDF/El%20Comprimido_n_6.pdf
-Delgado O,
Puigventós F, Pinteño M, Ventayol P.
Equivalencia terapéutica: concepto y niveles de evidencia. Med Clin (Barc) 2007; 129 (19): 736-45.
-Delgado O, Puigventós F Equivalencia terapéutica.
Capítulo del Libro Bases para una evaluación y
selección de medicamentos basada en la evidencia E. López Briz, J.L. Poveda Andrés eds. (en prensa 2008)
De todas maneras, lo
más habitual es no tener ensayos comparativos directos entre los dos fármacos
que comparamos, pero si disponer de estudios de cada uno de ellos con un tercer
comparador común. En este caso valorar el RAR, el RR, el NNT y sus IC95%. Tabular para facilitar la comparación, comprobando
previamente si son similares las características de los pacientes en ambos
estudios. (tabla 4)
|
Tabla. 4 Eficacia comparada entre los distintos
fármacos. Estudios independientes frente a un tercer comparador común |
|||||
|
|
Variable |
|
|
|
|
|
|
Resultado Fármaco |
Resultado Control |
RAR (IC 95%) |
NNT (IC 95%) |
RR (IC95%) |
|
Ensayo a |
A (IC 95%) |
B(IC95%) |
A-B (IC95%) |
X (IC 95%) |
X (IC 95%) |
|
Ensayo b |
C (IC 95%) |
B(IC95%) |
C-B (IC95%) |
X
(IC 95%) |
X
(IC 95%) |
En base al tipo de estudios,
la equivalencia terapéutica se clasifica en 5 niveles y grados de evidencia
(ver tabla 5).
|
Tabla 5. Clasificación de niveles y
grados de evidencia |
|||||
|
Niveles de evidencia (NE) |
Grados de Evidencia (GE) |
||||
|
|
NE |
Tipos de estudio |
Calidad elevada |
Calidad moderada |
|
|
Evidencia |
1 |
Ensayos Clínicos directos de equivalencia y
de No-inferioridad |
Muy elevada |
Elevada |
|
|
Estimación |
2 |
Ensayos Clínicos directos de superioridad con
significación estadística y sin relevancia clínica |
Elevada |
Moderada |
|
|
3 |
Ensayos Clínicos directos de superioridad
sin significación estadística |
Elevada |
Moderada |
||
|
4 |
Ensayos Clínicos indirectos. Comparación indirecta
frente a un comparador común |
Moderada |
Baja |
||
|
5 |
Ensayos Clínicos indirectos frente a
comparadores diferentes |
Baja |
Muy baja |
||
|
5 |
Estudios observacionales. Programas
concretos con evaluación de resultados clínicos |
Baja |
Muy baja |
||
|
Soporte a niveles anteriores (Niveles de Evidencia y Grados de
Evidencia) a aplicar |
|||||
|
Soporte |
2-4 |
Metanálisis que incluye varios principios
activos de la misma clase y que presenta resultados específicos por principio
activo y no muestra diferencias |
Pasar a nivel 2 si
se basa en estudios comparativos
directos y a nivel 4 si indirectos (aplicar calidad elevada) |
||
|
2-4 |
Revisiones sistemáticas |
Pasar a nivel 2 si
se basa en estudios directos y a nivel 4 si indirectos (aplicar calidad
moderada) |
|||
|
1-5 |
Revisiones de fuentes independientes |
Pasar al nivel en
que se basa. Si no se explicita nivel
5 |
|||
|
1-5 |
Fuentes elaboradas tipo DrugDex de
Micromedex, UptoDate |
Pasar al nivel en
que se basa. Si no se explicita nivel
5 |
|||
|
1-5 |
PIT y Guias de Intercambio de otros centros |
Pasar al nivel en
que se basa. Si no se explicita nivel
5 |
|||
|
1-5 |
Editoriales
(opinión de expertos) |
Pasar al nivel en
que se basa. Si no se explicita nivel
5. Util para aplicar grado basado en calidad |
|||
|
5 |
Metanálisis que incluye varios principios
activos de la misma clase y con test heterogeneicidad pasado |
Pasar a nivel 5 |
|||
|
5 |
GPC en que no se explicita preferencia por
un principio activo |
Pasar a nivel 5 |
|||
Ejemplos; ver tabla 6.
|
Tabla 6. Ejemplos |
||||||
|
|
Nº de estudios de cada nivel |
Nivel de evidencia (Grado de evidencia) |
||||
|
|
1 |
2 |
3 |
4 |
5 |
|
|
Tenecteplase/Alteplase (infarto agudo de miocardio)
|
1 |
|
|
|
|
|
|
Darbopoetina/Eritropoyetina (anemia por IRC)
|
2 |
|
|
|
|
1
(Muy elevado) |
|
Peginterferón alfa 2a/alfa 2b (VHC g1)
|
|
|
|
2 |
|
4
(Moderado) |
|
Azitromicina/Claritromicina (infección respiratoria)
|
|
1 |
|
1 |
|
2
(Elevado) |
|
Fondaparinux/Enoxaparina (profilaxis tromboembolismo)
|
|
|
4 |
|
|
3
(Elevado) |
|
Darbepoetina/Eritropoyetina (anemia por quimioterapia)
|
|
|
|
2 |
|
4 (Moderado) |
|
Pegfilgrastim/Filgrastim (neutropenia)
|
2 |
|
|
|
|
1 (Muy elevado) |
|
Ganciclovir/Valganciclovir (prevención inf. CMV trasplante)
|
1 |
|
|
|
|
1 (Muy elevado) |
|
Adalimumab/Etanercept (artritis reumatoide adulto)
|
|
|
|
3 |
|
4 (Moderado) |
|
Escitalopram/Citalopram (Depresión Mayor)
|
1 |
1 |
1 |
|
|
1 (Muy elevado) |
|
Doxo liposomal/Doxo liposomal pegilada (c mama metast) |
|
|
|
|
2 |
5 (Bajo) |
|
Emtricitabina/Lamivudina (Infección HIV) |
2 |
|
|
|
|
1 (Muy elevado) |
Evaluar Seguridad
Para evaluar la seguridad y compararla se ha de tener en cuenta:
a-Frecuencia de la Reacciones Adversas a
Medicamentos (RAM),
-Ensayos clínicos directos entre los fármacos
estudiados o ensayos indirectos con un
tercer comparador.
Si
se dispone de ensayos clínicos que evalúan este aspecto se determina, de forma
similar a los datos de eficacia. En vez del NNT empleamos el número necesario
de pacientes tratados para obtener una unidad adicional del efecto indeseable o
daño (NNH ó NND).
-Centros
de Farmacovigilancia y Agencias
Revisar
datos provenientes de comunicación de RAM.
Revisar
datos de estudios fase IV.
-Otras fuentes
Informe EMEA.
Fuentes secundarias.
Boletines.
b-Relevancia o gravedad de la RAM
-Aumento de mortalidad
-Amenaza vital
.Aumento de ingresos hospitalarios, prolongación de
los mismos, enfermedad incapacitante
-RAM moderada
-RAM leve
c-Tiempo
desde comercialización (experiencia de uso)
La experiencia de uso es un elemento importante. Se priorizará el fármaco con más años de uso.
|
|
Con todo la
información anterior, definir si alguno
de los dos fármacos estudiados presenta una mejor relación beneficio riesgo y
ello es clínicamente relevante y con evidencias adecuadas.
Definir en segunda opción si hay información suficiente para
poder ser considerados equivalentes en relación al beneficio riesgo comparado
|
|
Conveniencia
Este
criterio engloba otras posibles características del medicamento relacionadas
con la administración, posología, disponibilidad, aceptabilidad por el
paciente, o incluso aceptabilidad por el clínico.
Dependiendo
de su relevancia, resulta adecuado sopesar estas ventajas frente al coste.
Cuando
un medicamento aporta ventajas de conveniencia relevantes, debe comprobarse si
existen datos objetivos, de que estas ventajas se traducen en una mejora de la
efectividad en resultados de salud. Como mínimo podemos determinar si hay evidencias de que la mejor
conveniencia produce alguna mejora en alguna variable intermedia, como es
por ejemplo la adherencia al
tratamiento.
En el
caso de que produzcan mejoras de la efectividad, ello es un punto objetivo a
favor de incorporar el fármaco. Cuando disponemos de estudios, en que se
demuestra mejora de la adherencia al tratamiento, podemos calcular el
coste-conveniencia incremental. Es decir cuantos recursos son necesarios para
conseguir un valor adicional de adherencia al tratamiento. Su cálculo es
similar al de CEI. De hecho incluso podría considerarse una forma más de
expresar el CEI.
El
papel de la conveniencia como criterio secundario para el posicionamiento
terapéutico, se expresa en los algoritmos de ayuda la decisión del apartado anterior
de este documento.
|
|
Coste y Coste eficacia incremental
El análisis económico se realizará de manera diferente
según las dos opciones que se pueden presentar
|
|
A-Medicamentos
Equivalentes en eficacia y seguridad:
Calcular costes
directos comparados. En general será el coste de adquisición en los centros
hospitalarios o el coste para el sistema de salud en los medicamentos de prescripción en receta y uso ambulatorio. Ver
tabla 7.
|
Tabla
7 Comparación
de costes del tratamiento evaluado frente a otra/s alternativa/s |
|||
|
|
Medicamento |
||
|
|
Medicamento A Presentación |
Medicamento B Presentación |
Medicamento C Presentación |
|
Precio unitario PVP o (PVL+IVA)
* |
|
|
|
|
Posología |
|
|
|
|
Coste día |
|
|
|
|
Coste
tratamiento completo o
tratamiento/año |
|
|
|
|
Costes asociados a ** |
|
|
|
|
Coste
global *** o
coste global tratamiento/año |
|
|
|
|
Coste
incremental (diferencial) **** respecto a la terapia de referencia |
|
|
|
|
* Para informes de un hospital, valorar tb precio del medicamento según ofertas **Costes asociados: Son costes que podemos considerar además
del coste del medicamento estudiado. Por ejemplo otros medicamentos
adicionales requeridos. Se tendrán en
cuenta cuando sean relevantes. En caso necesario añadir más filas. ***Suma del coste del tratamiento completo + costes asociados. ****Diferencia de coste global respecto al fármaco evaluado |
|||
Coste tratamiento/ día y coste/
tratamiento completo y global. El coste incremental por paciente es la
diferencia entre el coste del tratamiento por paciente de una alternativa y el
coste del tratamiento por paciente del tratamiento de referencia.
-Estimación
del Impacto económico de medicamentos equivalentes
En el caso de
hospitales los medicamentos con eficacia y seguridad equivalente se definen
como medicamentos homólogos, sujetos a negociación de precios y a selección del
de menor coste. En base al número de candidatos potenciales a recibir el
tratamiento se puede realizar una estimación del impacto económico que
representa la consideración de equivalencia terapéutica.
En el caso de medicamentos
de prescripción preferente en el paciente ambulatorio, elegir el menos costoso,
haciendo un pequeño estudio de minimización de costes, según la tabla anterior.
En este caso se hará
también un cálculo o estimación del impacto económico en el área, en función de
los datos conocidos de consumo del medicamento en el área. De esta forma se
puede dimensionar el impacto económico global, que puede tener el elegir uno u
otro fármaco. Tabla 8
|
Tabla 8.
ESTIMACIÓN DEL IMPACTO EN EL
ÁREA |
||||
|
Medicamento |
Pvp envase |
Dosis dia (DDD) |
Coste DDD |
Diferencia coste DDD |
|
A |
|
|
|
d |
|
B |
|
|
|
|
|
IMPACTO ECONOMICO DE
SUSTITUIR A POR B |
||||
|
Total de DDD B durante año: N . Diferencia de coste por DDD: d |
||||
|
Impacto económico en 1 año
de la sustitución total: N x d |
||||
|
Impacto
económico en 1 año de la sustituciión de un X %: (Nxd) x X % ( Ej; un 10% , un 50% o un 90%) |
||||
Ref:
Santolaya R. Problemas éticos en la interpretación del balance beneficio riesgo. En Requena T. Problemas éticos en
la práctica del farmaceutico de hospital. Monografías de la SEFH
|
|
B-Medicamentos
con diferencias pequeñas de eficacia y grandes de coste de adquisición: Se calculará
el coste eficacia incremental
El estudio económico irá orientado a estimar cuál es el Coste-eficacia
incremental (CEI), es decir
cuantos recursos adicionales deberemos aportar por cada unidad adicional de eficacia.
Ello ayuda a dimensionar el esfuerzo económico real que debe realizar el
sistema de salud y aporta un dato mucho
más relevante para la decisión que la simple comparación de costes de
los tratamientos.
-CEI datos
publicados
-Estudios farmacoeconómicos publicados se revisarán para
ver el grado de aplicabilidad de sus resultados a nuestro ámbito y para
orientar la realización de nuestros propios estudios. Sin embargo la validez y
sobre todo la aplicabilidad a nuestro
medio suele ser limitado, debido a la existencia de diferencias entre países o
entre diferentes lugares de un mismo país en cuanto a estrategias terapéuticas,
organizaciones sanitarias, utilización de recursos, costes unitarios. La
orientación promocional y otros sesgos
pueden ser también importantes. Priorizar los estudios de CEI o coste
utilidad publicados por organismos independientes.
|
|
-CEI datos propios
Realizar nuestra propia evaluación del Coste eficacia
incremental : Estimar el Coste eficacia incremental, teniendo
en cuenta sólo el coste del tratamiento en base a coste de adquisición del
medicamento por un lado y a los datos de eficacia aportados por el ensayo
clínico pivotal por el otro. CEI = NNT x (Diferencia de costes) . Ver tabla
9.
|
Tabla 9. Coste Eficacia Incremental (CEI) Variables binarias |
||||||
|
Referencia |
Tipo de resultado |
VARIABLE
evaluada |
Medicamento
con que se compara |
NNT (IC 95%) * |
Coste incremental (A-B) |
CEI (IC95%) |
|
Referencia
x |
Principal |
xxxx |
xxxx |
N (Ninf-Nsup) |
(A-B) €uros |
(A-B) x N (A-B) x N inf (A-B) x N sup |
|
Se presenta el resultado de CEI base según
el NNT datos ensayo clínico |
||||||
Si
el CEI es muy alto, valorar en este caso el ser selectivo en las indicaciones
(tratamiento de 2ª linea,...)
|
|
-Estimación del Impacto económico
Se trata de estimar el número (n) de pacientes candidatos a recibir el tratamiento más eficaz y más
caro en un ámbito determinado (hospital o área de salud) durante un tiempo
definido (ejemplo 1 año).
En base a ello podemos calcular el coste económico derivado de
tratar n pacientes, y estimar que beneficios clínicos obtendrán dichos
pacientes, si se consideran los resultados de eficacia de los ensayos.
Estimar el impacto económico en el hospital o en la comunidad
por un lado y los resultados sobre la
salud por otros, nos ayuda a dimensionar
cuales serán los costes y beneficios en un ámbito concreto y en un
tiempo concreto y nos ayuda a dimensionar lo que aporta el nuevo
medicamento.
Para dicho cálculo se puede emplear la
fórmula: Coste incremental x NNT. Ver tabla
10.
|
Tabla 10 Coste Eficacia
Incremental (CEI). Variables binarias |
||||||
|
Referencia |
Tipo de resultado |
VARIABLE evaluada |
Medicamento con que
se compara |
NNT (IC 95%) * |
Coste incremental (A-B) |
CEI (IC95%) |
|
Referencia x |
Principal |
xxxx |
xxxx |
N |
(A-B) €uros |
(A-B) x N |
|
Se presenta el resultado de CEI base según el
NNT calculado en el apartado y el coste incremental o diferencial |
||||||
Umbral
de coste eficacia incremental
En nuestro medio no hay establecido un umbral de CEI a partir de cual
aceptar o rechazar una propuesta.
Para poder comparar
el coste efectividad incremental derivado de la aplicación de diferentes
terapéuticas cuyos datos de eficacia se miden en variables también diferentes,
se usan los conceptos de “utilidad”. Los índices más
empleados son los AVG (años de vida
ganados, LYG en inglés) y AVAC (años
de vida ganados de calidad, QUALY en inglés). El criterio para
recomendar la adopción o rechazo de una intervención sanitaria en función del
coste efectividad incremental no está definido.
-En publicaciones de
origen EEUU se suelen establecer del orden medio de 50.000 dolares/ AVAC.
-En la mayoría de
estudios publicados en nuestro país los autores recomiendan la adopción de la
intervención cuando dicha cifra está por debajo de 30.000 euros por Año de Vida
Ganado (AVG) (Sacristán JA et al. ¿Qué es una tecnología sanitaria eficiente
en España? Gac Sanit 2002 16(4):334-43),
-El Nice establece: 25.000-35.000 libras por Año de Vida
Ganado Ajustado por Calidad (AVAC)
-Inflexión A:
5.000-15.000 £/AVAC. Usualmente aceptables
-Inflexión B: > 25.000-35.000 £/AVAC. Solo aceptables en
condiciones especiales
(Rawlins MD,
Culyer AJ: National Institute for Clinical Excellence, and its value judgments.
BMJ 2004,
329: 224-7).
-De Cock E et al Pharmacoeconomics 2007. Revisa los valores empleados en 334 estudios
publicados en España. Concluye que:
-Umbral razonable; 30.000€ a 45.000 €/AVAC
Para nuestro propósito, y para valorar de forma comparativa las
distintas alternativas, puede ser util construir una tabla comparativa de
impacto económico y beneficio en salud. La propuesta se desarrolla en la
metodología del grupo Génesis (http://genesis.sefh.es/basesmetodologicas/programamadre/index.html) y en el
artículo de Puigventós F (Med Clin (Barc) 2001, 116:465-68)
|
|
|
|
Referencias
Vilaseca J, Espinàs J coordinadores:
Guía Terapéutica en Atención Primaria. Basada en la Evidencia. 2 ª ed. Sociedad
Española de Medicina de Familia y Comunitaria. SemFYC. Barcelona 2004
Diogéne E, Rodríguez D: Prólogo en: Guía
Terapéutica en Atención Primaria. Basada en la Evidencia. 2 ª ed. Sociedad
Española de Medicina de Familia y Comunitaria. SemFYC. Barcelona 2004
Alegre EJ : Evaluación de nuevos
fármacos. Revista Oficial de la Sociedad Andaluza de Farmaceuticos de Hospital.
2005; 1, 2: 26-34
Ebell MH et al Strength of Recommendation Taxonomy (SORT): A
patient-centered approach to grading evidencie in the medical literature. Am
Fam Physician 2004, 69: 548-56.
Puigventós F, Delgado O, Ventayol
P, Martinez-Lopez I: Definir el lugar del fármaco en terapéutica y las
condiciones de uso. Manual para la evaluación de nuevos medicamentos en el
hospital. Versión nº 6. Marzo 2006. Internet: Publicación electrónica: http://www.elcomprimido.com/FARHSD/ManualOlotPortadaCast.htm
Comité mixto de evaluación de nuevos medicamentos: Procedimiento normalizado
de trabajo del comité mixto de evaluación de nuevos medicamentos de Andalucia,
Pais Vasco, Instituto Catalán de la Salud, Aragón y Navarra (CMENM). 7 ª
versión, septiembre 2005. Internet:
Puigventós F, Ventayol P, Pinteño M, Delgado O, Campoamor F, Serra J:
Futuro de la selección de medicamentos en el hospital. Todo Hospital nov 2005:
634-638.
Soto J; Valor terapéutico añadido de los medicamentos, ¿qué es, cómo
se evalúa y cual debería ser su papel en política farmacéutica?. Anales de
Medicina Interna 2005, 22: 1: 39-42
Declaración de la Sociedad Internacional de Boletines de Medicamentos
(ISBD) sobre avances en terapéutica con medicamentos, 2002
Moreno-González A y grupo de trabajo FUINSA sobre Guías terapéuticas:
Guías terapéuticas. ¿Qué puede esperarse de ellas? Med Clin (Barc) 2005, 125(11):421-2
Grupo de trabajo GENESIS de la SEFH: Programa
Madre de ayuda a la redacción de informes de evaluación de un nuevo
medicamento. Manual de procedimientos.
Versión 3.0
Septiembre 2005.Publicación electrónica:
http://genesis.sefh.es
Medicamento
Puigventós
F Novedades terapéuticas del año 2000, los retos del médico y del gestor. Med Clin (Barc) 2001: 116: 465-68
Puigventós
F, Martínez-López I, Delgado O: La relación beneficio/riego: un punto clave en
la evaluación de nuevos fármacos. Noticias Farmacoterapéuticas. 2002; 32: 2-4.
Martínez-López I, Puigventós F, Delgado O,
Ventayol P, Gines J, Cervera M, Escriva A, Comas F. Informes normalizados de
evaluación de medicamentos: resultados de dos años de aplicación. Aten Farm 2003; 5,4: 255-60
Moreno A y grupo de trabajo Fuinsa sobre Guías Terapéuticas:
Directrices para el desarrollo y la evaluación de guías terapéuticas: elementos
y recomendaciones para su diseño y elaboración” Med Clin (Barc) 2007) 128,3:
100-110.,
Pinteño
M, Martinez-López I, Delgado O: equivalentes terapéuticos: concepto y niveles
de evidencia. El Farmacéutico Hospitales. 2006; 178:
Pinteño
M, Martinez-López I, Delgado O: Area de formación: Equivalentes terapéuticos:
Concepto y niveles de evidencia. El comprimido 2006, 6: 14-20.
Bosch
M, Diogene E, Laporte JR: Index
Farmacològic Academia de Ciències Mèdiques de Catalunya i Balears. 5ed 2000
O
Delgado , F Puigventós M Pinteño y P
Ventayol Equivalencia terapéutica:
concepto y niveles de evidencia
Med Clin (Barc). 2007;129(19):736-45